产品中心

关于注射用重组人生长激素国家药品标准草案的公示
国家药典委员会2019年7月3日发布。
本品系由含有可高效表达人生长激素基因的工程化细胞,经过发酵、分离和高度纯化后获得的重组人生长激素(rhGH)冻干制成。加入适宜稳定剂和保护剂,不含抗生素和防腐剂。每1mg无水重组人生长激素相当于3.0单位。
基本要求:
1、生产和检定用设施、原材料及辅料、水、器具、动物等应符合“凡例”的有关要求;
2、重组人生长激素工程化细胞名称、来源及种子批检定应符合批准的要求;
3、发酵用培养基采用适宜的不含抗生素的培养。
原文地址:http://www.chp.org.cn/view/ff8080816a583947016bb836dfbc22f8?a=BZSWZP
关于《中国药典》三部生物制品实验动物质量控制、禽源性病毒荧光定量PCR(Q-PCR)检查法等国家药品标准草案的公示
国家药典委员会2019年7月12日发布。
禽源性病毒荧光定量PCR(Q-PCR)检查法:
本法适用于禽源性生物制品的检测,本法用提取的供试品RNA,反转录成cDNA后,或用提取的供试品DNA,针对3种外源性禽病毒设计特异性引物探针,进行荧光定量 PCR检测特异性扩增信号,从而测定供试品中外源性禽源病毒核酸序列,以检查供试品的外源性禽病毒污染。
要求检测的3种禽源性病毒:
1.禽腺病毒I型(DNA病毒);
2.禽腺病毒III型(DNA病毒);
3.外源性禽白血病病毒(逆转录病毒)。
生物制品实验动物质量控制:
生物制品实验动物分为生物制品生产用实验动物和检定用实验动物。生产用实验动物是指用于生物制品生产的实验动物,检定用动物则是用于生物制品检定的实验动物。本通则是对生物制品生产用和检定用实验动物微生物与寄生虫学的质量控制要求。实验动物的管理应符合国家相关要求。

原文地址:http://www.chp.org.cn/view/ff8080816a583947016be3c67fc37985?a=BZSWZP
关于甘精胰岛素和甘精胰岛素注射液国家药品标准草案的公示
国家药典委员会2019年7月12日发布。
本品系由含有可高效表达甘精胰岛素的基因的工程化细胞,经发酵、分离、高度纯化、结晶和干燥制成。甘精胰岛素为21A-甘氨酸-30Ba-L-精氨酸-30Bb-L-精氨酸-人胰岛素,在结构上与人胰岛素相比在链A的21位置由甘氨酸代替门冬酰胺,在链B的C末端增加了2个额外氨基酸,即精氨酸(B31)和精氨酸(B32)。按干燥品计,含甘精胰岛素应为95.0%~105.0%,每1单位甘精胰岛素相当于0.0364mg。
基本要求:
1、生产和检定用设施、原材料及辅料、水、器具、动物等应符合“凡例”的有关要求;
2、本品为重组DNA技术生产的由53个氨基酸残基组成的蛋白质,工程菌菌种名称、来源及种子批检定应符合批准的要求;
3、发酵采用适宜的不含抗生素的培养基进行培养。

原文地址:http://www.chp.org.cn/view/ff8080816a583947016be3c998e37990?a=BZSWZP
关于重组治疗类生物制品国家药品标准修订内容的公示
国家药典委员会2019年7月15日发布。

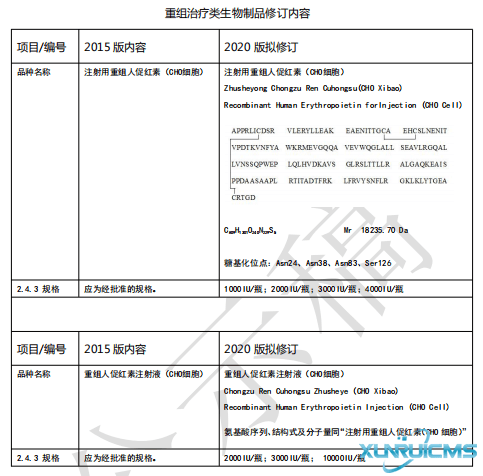

更详细内容请点击链接查看:http://www.chp.org.cn/view/ff8080816a583947016bf39783803eea?a=BZSWZP
以上就是近期发布的国家药品标准草案公示及修订内容公示。明年2020年版《中国药典》出版,预计接下来还会有一系列新法规出台,请关注冀百康生物微信公众号,小编将持续为您更新。
)