产品中心

2019年06月24日,中国国家药典委员会公布了《关于通则重组胰蛋白酶检测要求国家药品标准草案的公示》为确保标准的科学性、合理性和适用性,设定公示期为三个月,以征求社会各界意见。
原文地址:
http://www.chp.org.cn/view/ff8080816a583947016b88987de55cb4?a=BZSWZP
自2015版的《中国药典》以来,只提出了胰蛋白酶的检测标准,和新提出的重组胰蛋白酶检测标准对比有什么区别呢?
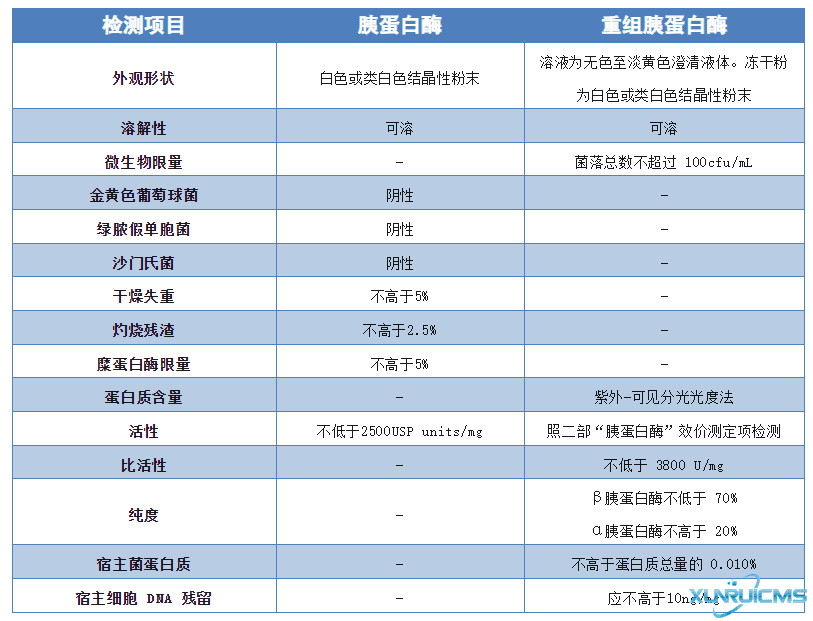
与2015年版的《中国药典》中的胰蛋白酶的检验标准相比,重组胰蛋白酶增加了微生物限度、蛋白质含量、比活性、纯度等项目的检验。减少了各种菌、干燥失重、糜蛋白酶限量(胰蛋白酶是通过重组的方法生产,因此不含糜蛋白酶活性)的指标。
传统的胰蛋白酶是动物源性的,很可能带来病毒感染的风险,如今,重组的胰蛋白酶逐渐成为主流。2014年,美国药典附录“制药用辅料--酶”部分,颁布了重组胰蛋白酶标准。
我们来看一下美国药典中,两种胰蛋白酶的标准的主要不同点:

珠海冀百康重组胰蛋白酶
重组胰蛋白酶(Trypsin,EC3.4.21.4)
1项国家发明专利CN201811428317.X,
具有高活性、高纯度、无动物源性的重组蛋白水解酶。
产品优势:
♦无动物源性:使用微生物生产,产品无病毒污染,不使用任何动物源的材料。
♦符合美国药典USP42和中国药典2020版公示稿的标准。
♦质量稳定:可保证连续稳定的批量生产,批间质量差异小。
♦合规性:生产设备和生产环境符合相关法规要求,符合GMP指导原则。
♦质量文件完整:按客户需求,可提供相关法规支持文件。
产品链接:http://zhuhaigbc.com/pro1/176.html
)