产品中心

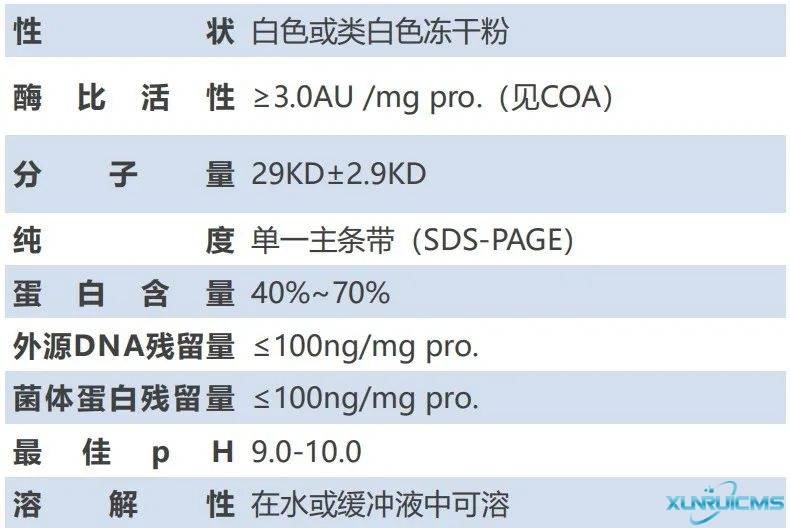
重组赖氨酰内切酶选用Achromobacter lyticus基因,能够克服大肠杆菌表达难题。选育高活性菌株,经高密度发酵、分离纯化和冷冻干燥而制成的冻干粉,可特异性切割赖氨酸残基羧基端的肽键,具有天然赖氨酰内切酶相同的特异性和活力。
本品属于生物化学级别的基因工程酶,不含有其他杂蛋白酶,不含DFP、PMSF和TLCK等酶抑制剂。
产品安全
生产菌株
第四类(最高级别);
不会引起人类或者动物产生疾病的菌株
生产原料
第三级原材料;
生产过程不使用任何动物源原料
质控标准
制药原料标准;
符合中国药典2020版的标准
超高的比活性
从菌株到成品,注重每一个细节,
使每个酶分子具有天然构象和最高活性。
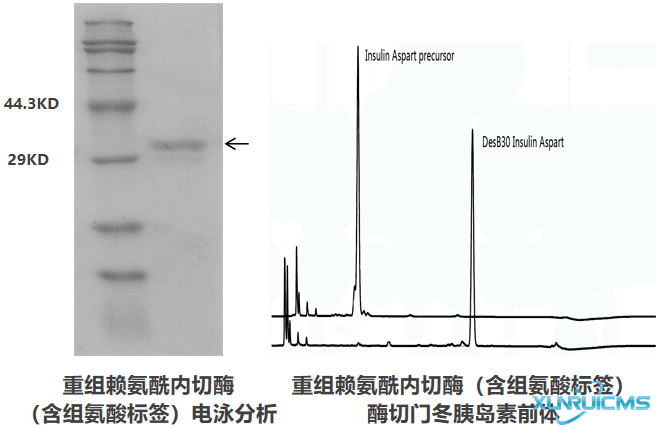
● SDS-PAGE电泳,单一主条带
● 酶的比活性≥3.0AU/mg pro.
● 酶切效率高,2AU酶即可完全酶切1g大多数融合蛋白
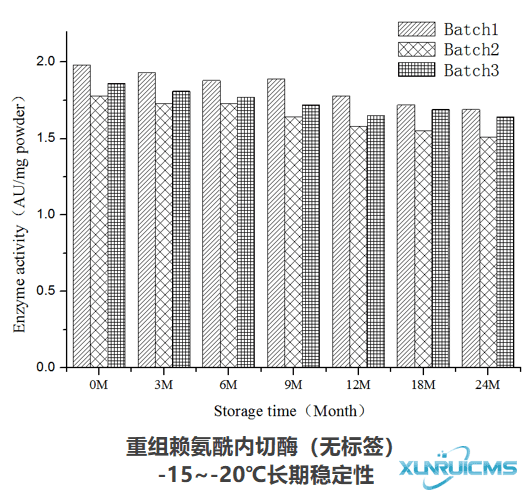
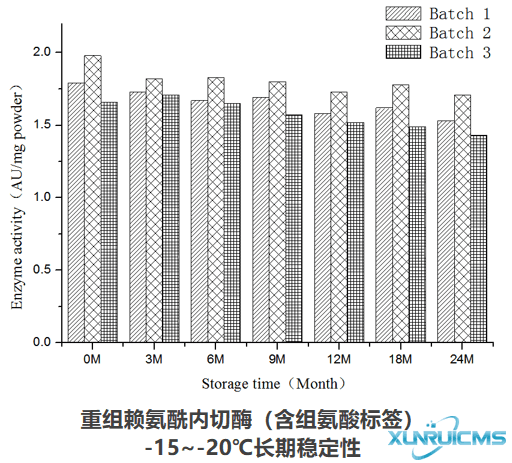
产品稳定性
产品可在-15~-20℃稳定存放24个月
产品优势
● 生化级和质谱级的专利技术产品
● 选育高活性菌株,经高密度发酵、分离纯化和冷冻干燥而制成的冻干粉,具有天然赖氨酰内切酶相同的特异性和活力
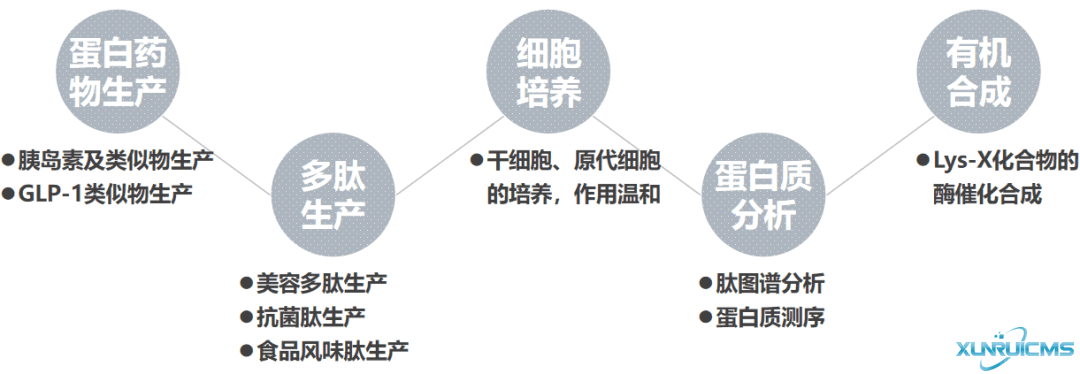
● 可应用在生物药如:胰岛素、GLP-1类似药生产,蛋白质分析、干细胞、原代细胞培养,以及Lys-X化合物的酶催化合成

产品用途
产品规格


产品参数